Kohlenhydrate
Kohlenhydrate (Zucker) kommen weit verbreitet im Körper vor z. B. in Form von Glykogen in Leber und Muskulatur, als Bausteine der Zellmembran (Glykoproteine und Glykolipide), in Sekreten (Mucine), oder sie sind wichtige Komponenten der Bindegewebematrix (Proteoglykane) und sind am Aufbau von Plasmaproteinen beteiligt. Zucker treten in zwei Erscheinungsformen auf: als reiner Zucker oder als kohlenhydrathaltige Komplexe (Glykokonjugate, vor allem Glykoproteine und Glykolipide). Polysaccharide (Glykane) sind lineare oder verzweigte Aggregate einfacher Zucker (Monosaccharide) in glykosidischer
Bindung, die bei Hydrolyse dieser Bindungen mehr als 10 Monosaccharide liefern. Das bekannteste Polysaccharid ist das aus Glukoseeinheiten aufgebaute Glykogen. Glykoproteine sind glykosylierte Proteine. Manchmal wird ziemlich willkürlich zwischen Glykoproteinen (geringer Zuckeranteil) und Mucinen (Schleime, hoher Zuckeranteil) unterschieden, aber im Allgemeinen spricht man heute insgesamt nur noch von Glykoproteinen. Mucine sind also hochmolekulare Glykoproteine mit hohem Zuckeranteil.
Glykoproteine geben typischerweise eine positive PAS Reaktion. Zahlreiche Glykoproteine finden sich an den Zellmembranen als Glykocalyx. Weiterhin findet man Glykoproteine in Basalmembranen und in den PAS-positiven Zellen des Hypophysenvorderlappens sowie in schleimsezernierenden Zellen. Polyanionische Glykoproteine (saure Mukopolysaccharide) kommen verbreitet in der extrazellulären Grundsubstanz des Bindegewebes vor. Beispiele sind Proteoglykane, die typische Seitenketten aus polymeren Disacchariden tragen, die Glykosaminoglykane genannt werden. Obwohl praktisch alle Kohlenhydrate an Protein gekoppelt vorkommen, nimmt die histologische Untersuchung auf diesen Umstand meistens keine Rücksicht, vernachlässigt den Proteinanteil und verfährt so, als existierten die verschiedenen Kohlenhydratanteile als unabhängige Moleküle, was aber nur unter seltenen Umständen zutrifft. Der Proteinanteil ist oft immunhistochemisch nachweisbar, z. B. bei Proteoglykanen.
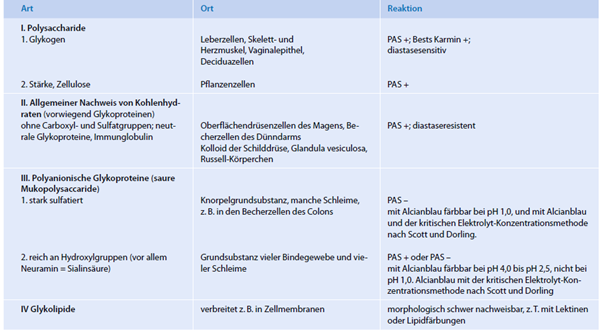
Der Überblick in der Tabelle hat sich für die praktische Arbeit bewährt. Hier sind die verschiedenen mit einfachen Färbemethoden unterscheidbaren Glykoproteine zusammen mit ihrem Vorkommen aufgelistet; die entsprechenden Methoden werden in den folgenden Abschnitten angegeben.
Aus dieser Liste geht hervor, dass zur Analyse der verschiedenen Glykoproteine folgende Färbereaktionen anzuwenden
sind:
PAS-Reaktion zum Nachweis von unsubstituierten 1,2- Glykolen; substituierte Glykolgruppen reagieren nicht.
Färbung mit Alcianblau zum Nachweis von polyanionischen Glykoproteinen, wobei zwischen Polyanionen mit Sulfat- und Carboxylgruppen unterschieden werden kann; die Färbung wird bei unterschiedlichem pH-Wert oder unter Zusatz unterschiedlicher Konzentrationen von MgCl2 durchgeführt.
Prüfung auf Resistenz gegen Neuraminidase (Sialidase) von Vibrio cholerae und anderen Bakterien.
Daneben sind noch weitere Techniken verbreitet, die auch die oft komplexe Architektur der Glykokonjugate im Gewebe sichtbar machen können, z. B. die Kombination von PAS-Reaktion und Alcianblau.
Es eignet sich neutrales Formalin, alle Mischungen aus Ethanol und Formalin, Formol-Calcium oder Carnoys Gemisch.
PAS-Reaktion nach McManus
PAS steht für Perjodic-Acid-Schiff-Reaktion.
Histochemischer Nachweis von Kohlenhydraten (Polysaccharide, Glykoproteine).
Wichtige und weit verbreitete „Spezialfärbung“ in der Histologie; sie ist unter anderem in der Karzinom-, Sarkom- und Lymphom-Diagnostik und bei der Differenzierung von Nierenkrankheiten von Bedeutung.
Die Fixierung ist beliebig; zum Nachweis von Glykogen Alkoholfixierung.
Die PAS-Reaktion ist auch mit anderen Färbungen kombinierbar, am häufigsten mit der Alcianblau-Färbung.
Prinzip:
Perjodsäure oxidiert bestimmte OH-Gruppen zu Aldehyden, diese Aldehyde reagieren mit dem Schiff-Reagenz (fuchsinschweflige Säure), über mehrere Stufen, und der Farbstoff Fuchsin wird frei (Aldehyde binden das Sulfit, Fuchsin wird frei). Die Reaktion wird sichtbar in Form eines pink-violetten Farbstoffes. Der anschließende Spülvorgang mit Sulfitwasser entfernt die überschüssige fuchsinschweflige Säure und verhindert damit falsch positive Ergebnisse. Bei Überoxidation stehen keine Aldehydgruppen für die Reaktion mehr zur Verfügung und es resultiert ein falsch negatives Ergebnis.
Lösungen:
0,5 % wässrige Periodsäure (McManus)
Schiff-Reagens: 1 g Pararosanilin = Parafuchsin (säurefrei) in 150 ml 1 N HCl lösen. 5 g Kalium- oder Natriummetabisulfit in 850 ml Aqua d. lösen und zur vorigen Lösung zugeben. 24 Stunden stehen lassen, es erfolgt ein Farbwechsel von rot nach blassgelb. Danach 3 g Aktivkohlepulver zugeben und mindestens 2 Minuten schütteln, dann 2 x filtrieren, es
ergibt ein farbloses, klares Filtrat. Lösung in dunkler Flasche und im Kühlschrank aufbewahren! Schiffsches Reagens muss immer einen Überschuss an schwefliger Säure enthalten (stechender Geruch), um vor Zersetzung bewahrt zu werden.
Bei rötlicher Färbung ist das Reagens unbrauchbar!
Quelle: Romeis Mikroskopische Technik, 19. Auflage 2015
Romeis
Mikroskopische
Technik,
19. Auflage
2015


