Das Wassermolekül - Ein Dipol
Damit wir verstehen können, warum ein Wasserstrahl durch ein statisch aufgeladenes Lineal abgelenkt werden kann, müssen wir noch einmal einen genaueren Blick auf das Wasser-Molekül werfen.
Im Wasser-Molekül bestehen Atombindungen zwischen dem Sauerstoff-Atom und den Wasserstoff-Atomen. Eine Atombindung besteht immer aus zwei Elektronen, die von den Atomen geteilt werden - das sind die Bindungselektronen.
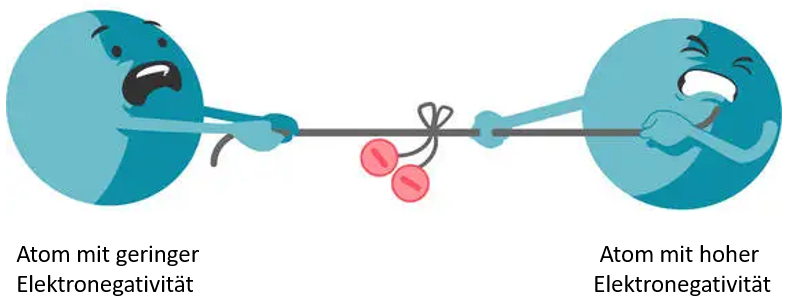
Tatsächlich befinden sich die Elektronen dabei aber nicht genau in der Mitte zwischen den Atomen. Eines der Atome kann die Elektronen stärker zu sich heranziehen.
Der Grund für diese Anziehung ist eine Eigenschaft von Atomen, die Elektronegativität genannt wird. Das ist ein Maß dafür, wie stark ein Atom in einer Bindung die Elektronen zu sich heranzieht. Je größer die Elektronegativität eines Atoms ist, desto besser kann es die Elektronen zu sich ziehen und desto näher befinden sie sich in der Bindung bei diesem Atom.
Die Elektronegativität ist eine so wichtige Eigenschaft, dass sie sogar im Periodensystem der Elemente aufgeführt wird.
https://www.tutory.de/entdecken/dokument/das-wassermolekuel-ein-dipol
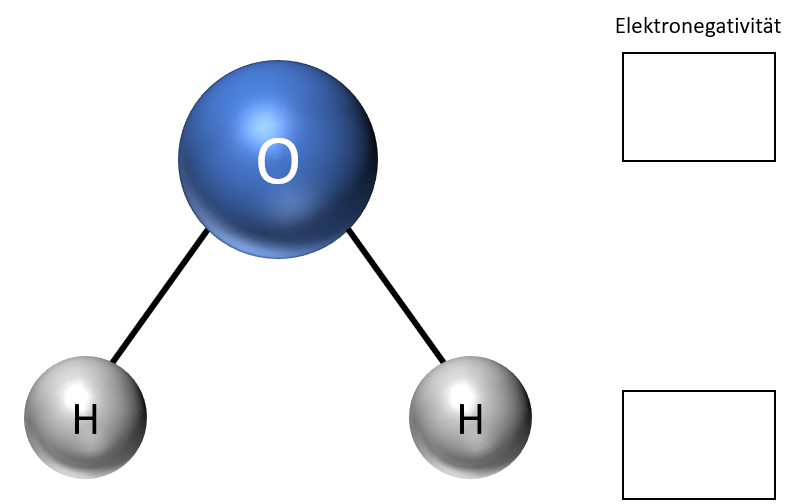
Trage diese in die Zeichnung ein.
https://www.tutory.de/entdecken/dokument/das-wassermolekuel-ein-dipol


