Hinweis zum Einsatz im Unterricht
Arbeitsplatz
Batterien und Akkumulatoren
Die Vorgänge in einer Batterie beruhen auf dem Prinzip der Galvanischen Zelle
, die du beim vorigen Thema (Chemische Wirkung des Stroms
) schon kurz kennengelernt hast.
Galvanische Zelle
In ein Säurebad (=Elektrolyt) werden zwei verschieden edle Stoffe eingetaucht. Zwischen den beiden Stoffen entsteht eine Spannung, weil sich vom unedleren Stoff positiv geladene Ionen ablösen und den edleren Stoff negativ aufladen. Am Ende dieser Energiegewinnung wird der unedlere Stoff aufgelöst - es fließt kein Strom mehr.
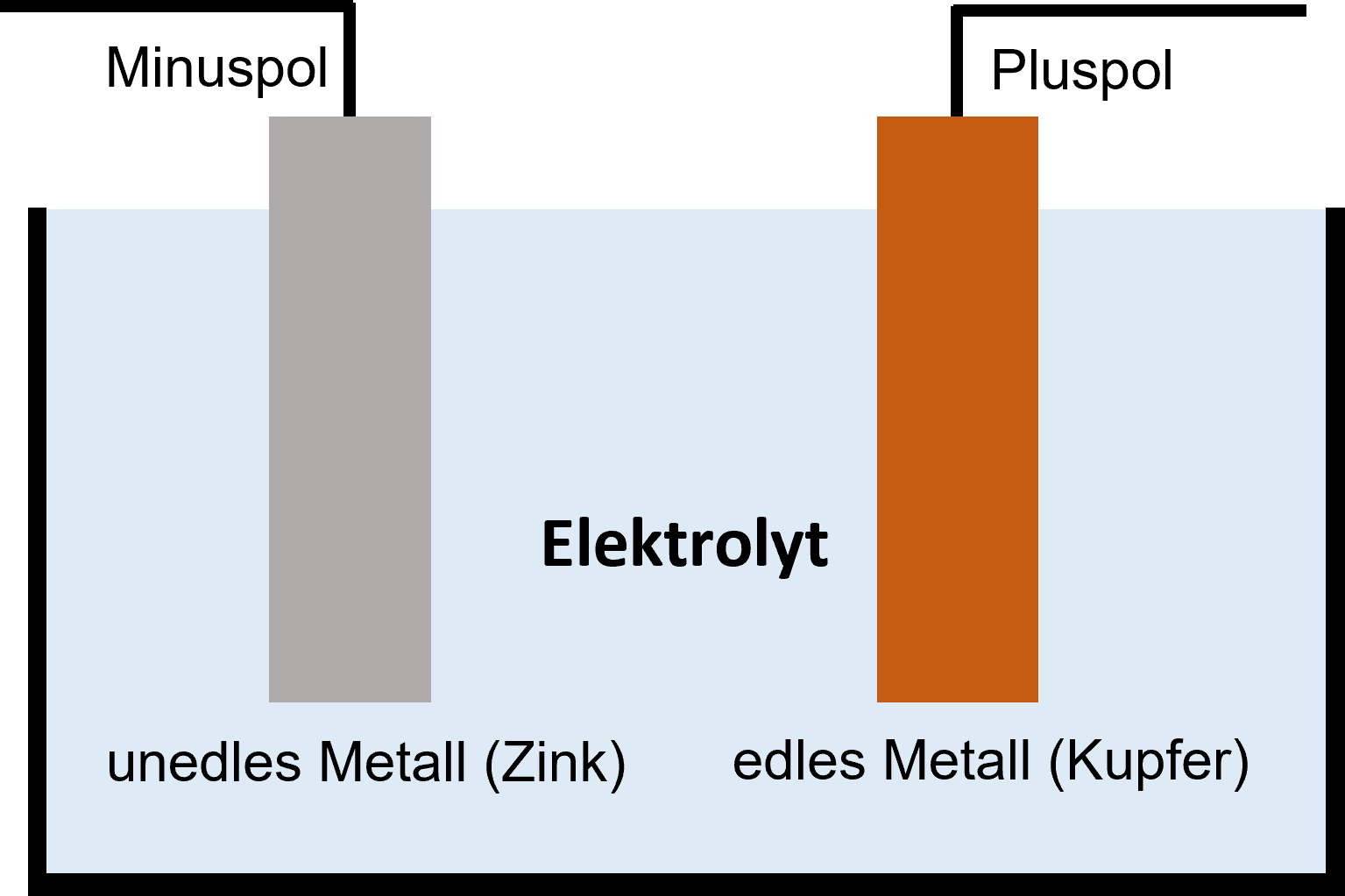
Metalle, die leicht oxidieren, werden als unedel bezeichnet, Metalle, die nur schwer oxidieren, als edel (Vergleiche mit Fachkunde Metall).
Mg | Al | Mn | Zn | Cr | Fe | Cd | Co | Ni | Sn | Cu |
unedel | ◀ | ◀ | ◀ | ◀ | ◀ | ◀ | ◀ | ◀ | ◀ | edel |
https://www.tutory.de/entdecken/dokument/batterien-und-akkumulatoren-1
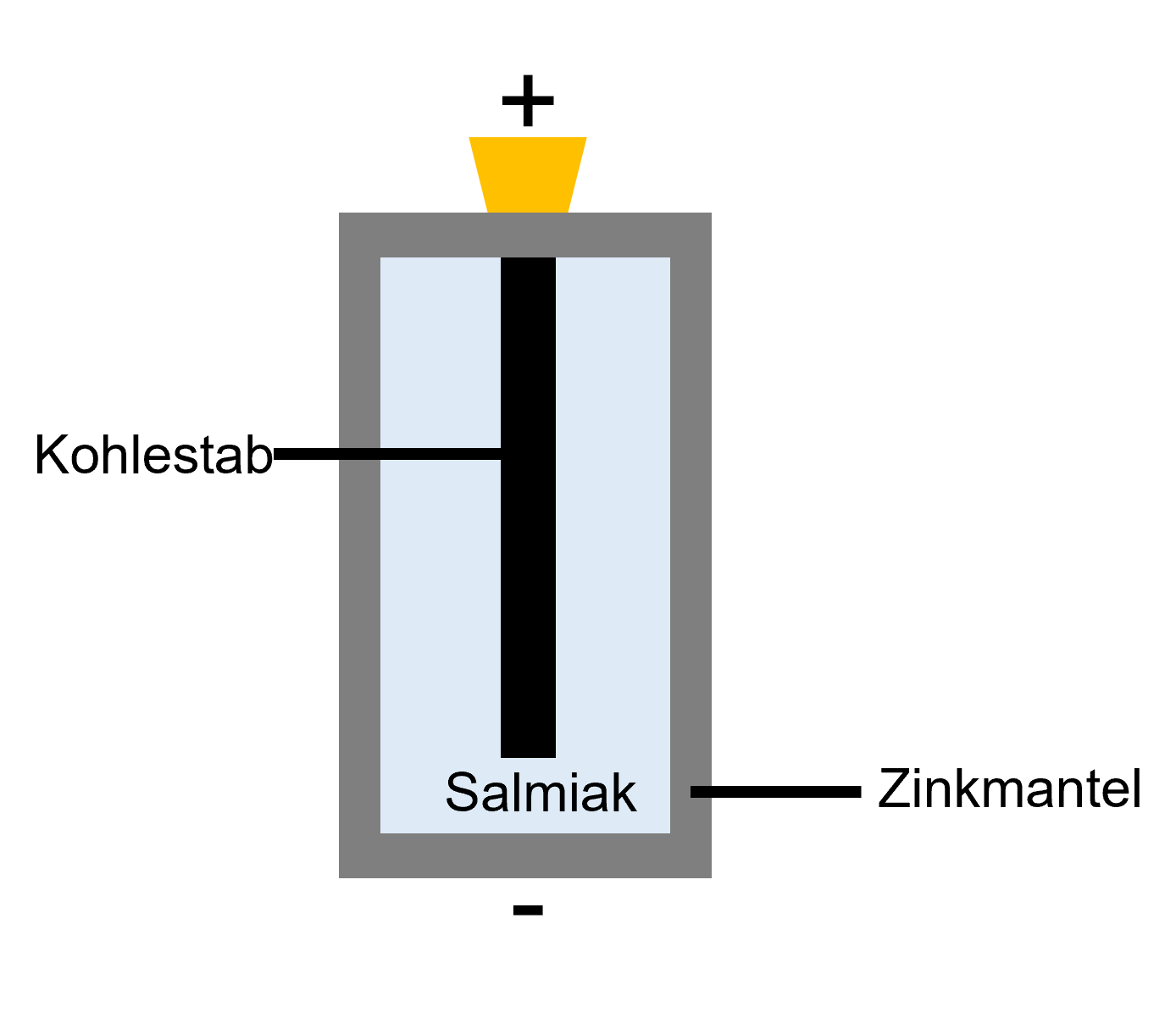
Einfache Zink-Kohle-Batterie
Für günstige 1,5 V Batterien werden häufig Zink-Kohle-Batterien verwendet. Die Hülle besteht aus Zink, im Inneren befindet sich ein Kohlestab. Als Elektrolyt wird eingedickter Salmiak verwendet.
Auch in der Batterie wird der unedlere Stoff aufgelöst - es fließt kein Strom mehr: Die Batterie ist leer.
Akkumulator (Akku)
Im Gegensatz zu Batterien sind die chemischen Vorgänge in Akkus
umkehrbar - Akkumulatoren können also wieder aufgeladen werden. Der Prozess des Ladens und Entladens lässt sich allerdings nicht unendlich oft wiederholen.
Akkus werden mit der Zeit schwächer - eine Erfahrung, die du sicher auch schon gemacht hast.
Am Beispiel eines Bleiakkus, den wir beispielsweise in Kraftfahrzeugen finden, können wir uns die chemische Reaktionsgleichung ansehen:
Pb+PbO2+2H2SO4↔2PbSO4+H2O
Heutzutage kommen allerdings hauptsächlich Lithium-Ionen- und Lithium-Polymerakkus zum Einsatz (Polymer = leitfähiger Kunststoff). Denk z. B. an dein Smartphone, Tablets und ähnliche Geräte.

https://www.tutory.de/entdecken/dokument/batterien-und-akkumulatoren-1
Und jetzt du:
- Lichtwirkung
- Wärmewirkung
- Chemische Wirkung
- Magnetische Wirkung
- Physiologische Wirkung
- Galvanisieren, Eloxieren
- Nerven, Gehirnströme
- Elektromotor, Lautsprecher
- Leuchtstoffröhre, Leuchtdiode
- Toaster, E-Herd
Die Gefährlichkeit des elektrischen Stroms ist abhängig von der - ab 40 V wird es gefährlich - und von der - ab 40 mA besteht Lebensgefahr. Außerdem spielen auch noch der sowie die , also wie lange man sich im Stromkreis befindet, eine Rolle.

https://www.tutory.de/entdecken/dokument/batterien-und-akkumulatoren-1


