Um die Lizenzinformationen zu sehen, klicken Sie bitte den gewünschten Inhalt an.
Name:
Auswertung einer Titration
04.05.2021
Die Methode der Titration
Titration
Die Titration ist eine Analyseverfahren, mit dem man die unbekannte Konzentration einer Lösung bestimmen kann.
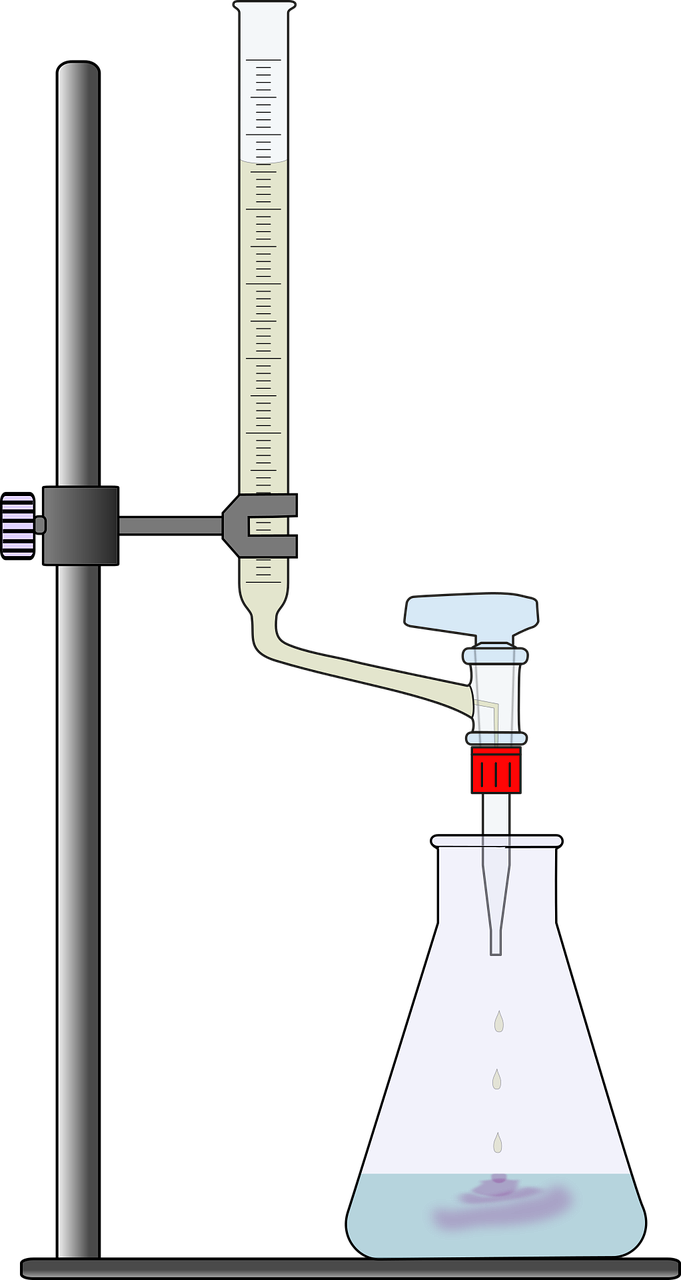
Versuchsaufbau
Durchführung:
Man füllt die Bürette mit Natronlauge der Konzentration c= 1molL bis zur Null-Marke auf.
In den Erlenmeyerkolben gibt man 10mL Salzsäure unbekannter Konzentration. Zudem werden 3-5 Tropfen Indikatorlösung (Bromthymolblau, Phenophthalein) hinzugegeben und der Rührfisch in Bewegung gesetzt.
Nun öffnet man vorsichtig den Hahn der Bürette und tropft die Natronlauge langsam zur Salzsäure. Dies wird so lange fortgesetzt, bis sich der Indikator umfärbt (Bromthymolblau: von gelb nach grün Phenphthalein: von farblos bis rosa) und den Äquivalenzpunkt der Lösung anzeigt.
Lies nun den Füllstand der Bürette ab. Der angezeigte Wert gibt den Verbrauch an Natronlauge an.
Man füllt die Bürette mit Natronlauge der Konzentration c= 1molL bis zur Null-Marke auf.
In den Erlenmeyerkolben gibt man 10mL Salzsäure unbekannter Konzentration. Zudem werden 3-5 Tropfen Indikatorlösung (Bromthymolblau, Phenophthalein) hinzugegeben und der Rührfisch in Bewegung gesetzt.
Nun öffnet man vorsichtig den Hahn der Bürette und tropft die Natronlauge langsam zur Salzsäure. Dies wird so lange fortgesetzt, bis sich der Indikator umfärbt (Bromthymolblau: von gelb nach grün Phenphthalein: von farblos bis rosa) und den Äquivalenzpunkt der Lösung anzeigt.
Lies nun den Füllstand der Bürette ab. Der angezeigte Wert gibt den Verbrauch an Natronlauge an.
Angaben zu den Urhebern und Lizenzbedingungen der einzelnen Bestandteile dieses Dokuments finden Sie unter
https://www.tutory.de/entdecken/dokument/auswertung-einer-titration
https://www.tutory.de/entdecken/dokument/auswertung-einer-titration
Name:
Auswertung einer Titration
04.05.2021
Chemischer Hintergrund zur Titration
Bei einer Titration ist es Ziel, den Äquivalenzpunkt zu bestimmen.
Die Säure mit der unbekannten Konzentration an Protonen wird in den Erlenmeyerkolben gefüllt. Hier kennt man also nur das eingefüllte Volumen und möchte die Stoffmenge n (H+) herausfinden.
Die Säure mit der unbekannten Konzentration an Protonen wird in den Erlenmeyerkolben gefüllt. Hier kennt man also nur das eingefüllte Volumen und möchte die Stoffmenge n (H+) herausfinden.
Um den Äquivalenzpunkt zu erkennen, gibt man einen Indikator hinzu, der durch einen Farbumschlag, den Äquivalenzpunkt anzeigt.
In die Bürette wird eine Natronlauge bekannter Konzentration gegeben, die sogenannte Maßlösung.
Durch Zutropfen bis zum Farbumschlag des Indikators bestimmt man das nötige Volumen der verbrauchten Maßlösung.
Beim Zutropfen ist es wichtig, die beiden Lösungen im Erlenmeyerkolben gut zu mischen (schwenken oder Rührfisch verwenden).
In die Bürette wird eine Natronlauge bekannter Konzentration gegeben, die sogenannte Maßlösung.
Durch Zutropfen bis zum Farbumschlag des Indikators bestimmt man das nötige Volumen der verbrauchten Maßlösung.
Beim Zutropfen ist es wichtig, die beiden Lösungen im Erlenmeyerkolben gut zu mischen (schwenken oder Rührfisch verwenden).
1
Übe nun das Titrieren:
Wähle unter Einstellungen
Wähle unter Einstellungen
Übungsmodus mit Hilfen.
2
Hast du genug geübt, dann wähle Anfänger und titriere erneut.
Wenn du das Volumen der Natronlauge abgelesen hast, dann kommst du auf der nächsten Seite zu allen Werten der Titration, die du zum Rechnen benötigst.
Schreibe sie in dein Heft. (siehe Seite 3)
Wenn du das Volumen der Natronlauge abgelesen hast, dann kommst du auf der nächsten Seite zu allen Werten der Titration, die du zum Rechnen benötigst.
Schreibe sie in dein Heft. (siehe Seite 3)
3
Nun kann es an das Rechnen gehen, um die Konzentration der Salzsäure zu ermitteln. Lies hierzu den Abschnitt Auswertung. (siehe Seite 3)
Notiere alle Rechenschritte vom Arbeitsblatt mit den von dir ermittelten Werten in dein Heft und gib die Konzentration der Salzsäure aus der Simulation an.
Notiere alle Rechenschritte vom Arbeitsblatt mit den von dir ermittelten Werten in dein Heft und gib die Konzentration der Salzsäure aus der Simulation an.
Angaben zu den Urhebern und Lizenzbedingungen der einzelnen Bestandteile dieses Dokuments finden Sie unter
https://www.tutory.de/entdecken/dokument/auswertung-einer-titration
https://www.tutory.de/entdecken/dokument/auswertung-einer-titration
Name:
Auswertung einer Titration
04.05.2021
Auswertung einer Titration
1
gegeben:
Base:
VB= 2,05mL
cB= 1mol/L
Säure:
VS= 10mL
Base:
VB= 2,05mL
cB= 1mol/L
Säure:
VS= 10mL
2
gesucht:
Säure:
cS
Säure:
cS
c=Vn=>n=c∗V
3
Berechnen der Stoffmenge nOH-
nOH-= 1mol/L * 0,00205L = 0,00205mol
Es wurden 0,00205mol Hydroxid-Ionen in den Erlenmeyerkolben gettopft.
Es wurden 0,00205mol Hydroxid-Ionen in den Erlenmeyerkolben gettopft.
4
Am Äquivalenzpunkt gil:
nH+ = nOH-
Somit befinde sich im Erlenmeyerkolben 0,00205mol Protonen (H+).
nH+ = nOH-
Somit befinde sich im Erlenmeyerkolben 0,00205mol Protonen (H+).
5
Berechnen der Konzentration c der Säure:
c=vn
c=0,010L0,00205mol=0,205Lmol
6
Die Säure besaß eine Konzentration von 0,205Lmol.
Angaben zu den Urhebern und Lizenzbedingungen der einzelnen Bestandteile dieses Dokuments finden Sie unter
https://www.tutory.de/entdecken/dokument/auswertung-einer-titration
https://www.tutory.de/entdecken/dokument/auswertung-einer-titration


