Bei Open-Clipart gibt es das gleiche Bild in weiteren Varianten. Von dort aus kann es auch heruntergeladen und bearbeitet werden.
Der Fachbegriff für das Rosten von Eisen und die allgemeine Bezeichnung für die Reaktionen von Werkstoffen mit ihrer Umgebung, die zu einer Beeinträchtigung führen kann, nennt man Korrosion.
Korridiertes Eisen platzt großflächig ab und dadurch kann das Bauteil seine Stabilität verlieren.
Hierbei handelt es sich um einen elektrochemischen Vorgang. Denn aufgrund unterschiedlicher Beanspruchungen, Vorbehandlungen und Einflüssen der Umgebung können sich Gebiete mit unterschiedlichem elektrochemischen Potential im Eisen bilden. Da diese Gebiete direkt aneinandergrenzen haben wir dabei eine Art kurzgeschlossenes galvanisches Element, ein sogenanntes Lokalelement.

A = Pluspol , B = Minuspol , C = Elektronenfluss , D = Elektrolyt , E = Ionenbewegung
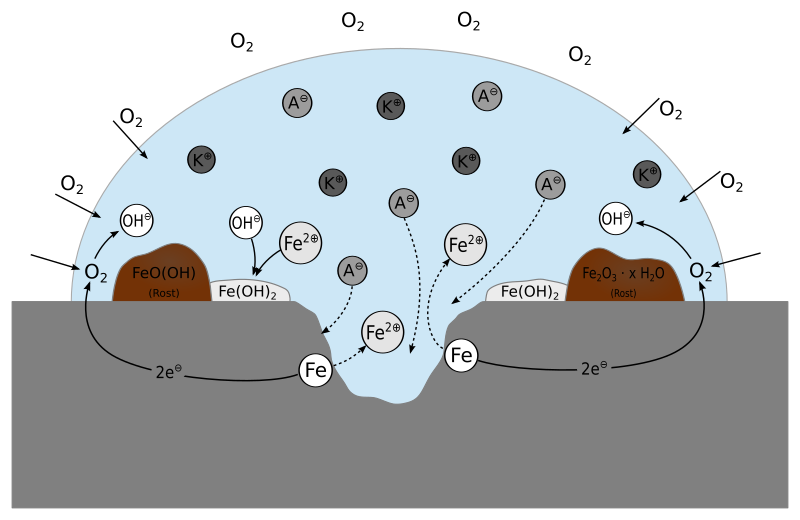
Minuspol (mit Oxidation):
Pluspol (mit Reduktion):
https://www.tutory.de/entdecken/dokument/4659c530

Das, was wir üblicherweise als Rost ansehen, ist kein Eisenoxid, wie häufig vermutet wird, sondern ein Gemisch aus verschiedenen Eisenoxidhydraten Fe₂O₃⋅H₂O und Eisenoxidhydroxiden FeOOH. Sie unterscheiden sich auch durch ihren Wassergehalt. Der Grund für das Abplatzen ist, dass es einen erheblichen Unterschied in den Dichten des Rostes im Vergleich zum metallischen Eisen gibt.
https://www.tutory.de/entdecken/dokument/4659c530


