Sicherheit
Eine eigene Gruppe von Stoffen in der Chemie sind die Säuren und Basen. Sie kommen in unmengen von alltäglichen Dingen vor und umgeben uns ständig. Man braucht Säuren oder Basen in der Reinigung, beim Essen oder in der Kosmetik. Viele dieser Flüssigkeiten oder Stoffe sind jedoch auch gesundheitsschädlich.
Listet Stoffe oder Flüssigkeiten aus eurem Alltag auf, von denen ihr denkt, dass sie Säuren oder Basen enthalten.
Ordnet sie auch zu ungesund für uns oder unbedenklich zu.
Ungesund für uns
Unbedenklich
Wie in der oberen Aufgabe gesehen, findest du rund um dich Säuren oder Basen. Da es auch Alltagsstoffe gibt, die gefählich sind, kann man nicht alles ohne Bedenken nutzen. Vor allem, wenn man irgendwelche Flüssigkeiten in einer PET-Flasche findet und diese nicht beschriftet ist. Schon oft sind dadurch schlimme Unfälle passiert indem Personen diesen Inhalt tranken. Deshalb sind die Gefahrensymbole oder Warnhinweise auf den verschiedenen Flaschen zu beachten. Säuren oder Basen haben eine ätzende Wirkung und greifen organisches Material an - so auch unsere Zellen.
Wenn du also mit chemischen Stoffen arbeitest, achte gut auf die Etiketten der Dose, Flasche oder Schachtel. Darauf befinden sich wichtige hinweise bezüglich ihrer Gefährlichkeit.
Die wichtigsten Gefahrensymbole sollte man kennen und wissen was sie bedeuten. Auf der nächsten Seite findest du eine Aufgabe dazu.
https://www.tutory.de/entdecken/dokument/0f9ff42d
Gefahrensymbole
- Ordne den Bildern links eine der Nummern mit den entsprechenden Erläuterungen zu.
1. Brandfördernd
Ein solcher Stoff unterstützt einen Brand oder kann mit brennbaren Stoffen so reagieren, dass es noch kräftiger brennt.
2. Gesundheitsschädlich
So gekennzeichnete Stoffe schaden der Gesundheit oder können Haut und Schleimhäute reizen. In höheren Konzentrationen können sie tödlich wirken.
3. Giftig
Dieses Zeichen signalisiert höchste Gefahr: giftig oder sehr giftig. Wenn man nur wenige Tausendstelgramm davon zu sich nimmt, kann dies tödlich sein.
4. Umweltgefährdend
Diese Stoffe können längerfristig schädliche Wirkungen auf die Umwelt haben. Sie wirken also giftig auf Lebewesen in Gewässern oder im Boden.
5. Leicht entzündlich
Ein so gekennzeichneter Stoff kann bei Temperaturen von weniger als 21°C anfangen zu brennen. Er kann aber auch mit Luft explosive Gemsiche bilden.
6. Explosionsgefählich
Unter bestimmten Bedingungen kann ein solcher Stoff explodieren, also schlagartig abbrennen. So kann nach einem Autounfall der Benzintank explodieren.
7. Ätzend
Darunter versteht man die Gefahr, dass ein Stoff, etwa eine Säure, lebendes Gewebe, also beispielsweise die Haut des Menschen, zerstört.
https://www.tutory.de/entdecken/dokument/0f9ff42d
Sauer oder nicht?
Experiment 1 - die Zunge als Messinstrument
Materialien: Einweglöffel, Einwegbecher, Zitronensaft, Essig, Vitamin C, Cola, Backpulver, Leitungswasser, Mineralwasser, Zucker
Versuchsdurchführung:
- Probiert die oben angegebenen Stoffe und beschreibt euren Geschmackseindruck (süss, neutral, scharf, stechend, prickelnd usw.).
- Gebt an ob der angegebene Stoff sauer schmeckt oder nicht. Trage es in die Tabelle ein.
Stoff | Geschmaks- eindruck | Schmeckt sauer | Schmeckt nicht sauer |
|---|---|---|---|
Natürlich darf nicht jede Flüssigkeit oder jeder Stoff mir der Zunge getestet werden. Dies wäre viel zu gefährlich und die Verletzungsgefahr viel zu gross. Um zu testen, ob die Flüssigkeit die zu untersuchen ist eine Säure oder Base ist, gibt es andere Möglichkeiten. Dies ist zum Beispiel mit dem Saft des Rotkohls (Blaukohl) möglich. Der Rotkohlsaft ist ein natürlicher Indikator. Zudem gibt der Indikator auch an, wie stark die getestete Säure oder Base ist. Nicht jede Säure oder Base ist gleich stark. Beispielsweise macht uns die Zitronensäure im Zitronensaft nicht allzu viel aus. Salzsäure hingegen würde zu schlimmen Verätzungen führen.
https://www.tutory.de/entdecken/dokument/0f9ff42d
Experiment 2 - die Zunge des Chemikers
Materialien: Die gleichen Stoffe, wie beim ersten Experiment. Zusätzlich 10 Reagenzgläser, Reagenzglasständer, Rotkohlsaft, Salzsäure (10%), Abflussreiniger
ACHTUNG: Schutzmassnahmen
Versuchsdurchführung:
- Füllt die Reagenzgläser jeweils ca. 2cm hoch mit dem Rotkohl-Filtrat.
- Gebt von den zu untersuchenden Flüssigkeiten etwa 1Milliliter in die Reagenzgläser. Bei den Feststoffen eine Messerspitze. Schüttelt vorsichtig und beobachtet die Farbveränderungen.
- Vergleicht die Farben mit der untenstehenden Skala. Protokolliert die Farbeindrücke in der Tabelle.
- Ordne die Stoffe anhand der Indikator-Farbe sinnvoll in eine der folgenden Gruppen: Säure, Base, weder - noch, noch nicht eingefärbt
Stoff | Farbe des Rotkohlsafts | Gruppe |
|---|---|---|
Zitronensaft | ||
Essig | ||
Vitamin C | ||
Cola | ||
Backpulver | ||
Leitungswasser | ||
Mineralwasser | ||
Zucker | ||
Salzsäure | ||
Abflussreiniger |
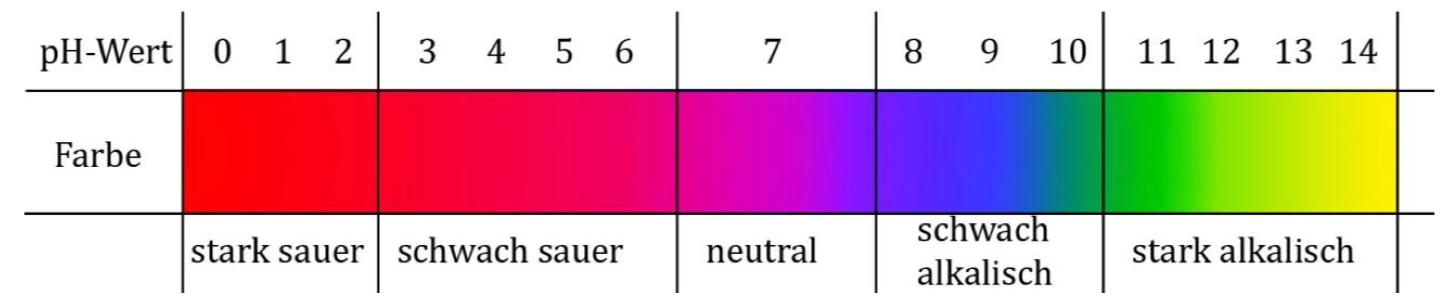
Bild: https://www.chids.dedachswisshausarbeiten/ExperimentelleHAKonenVPDF/V19.pdf
https://www.tutory.de/entdecken/dokument/0f9ff42d
Stoffe, die sind, färben den Rotkohlindikator
Indikatoren
Ein Indikator gibt an, ob eine saure oder alkalische Lösung vorliegt. Dies geschieht mit einer Farbveränderung. Ein Indikator wechselt seine Farbe, je stärker oder schwächer die zu testende Säure oder Base ist. Lackmus ist besipielsweise ein Farbstoff der aus Pflanzen gewonnen wird. Mit Säure wird er rot, mit Lauge blau. In unserem späteren Versuch werden wir Rotkohlsaft verwenden. Da dieser aber nicht lange haltbar ist, werden im Chemielabor zur Messung saurer oder alkalischer Lösunge spezielle Farbstoffgemische verwendet. Diese heissen Universalindikatoren. Wenn man Universalindikatoren benutzt, muss man die dazugehörigen Farbskalen benutzen. Jeder Indikator hat einen anderen Farbverlauf. Einerseits gibt es Teststreifen (aus Papier), die sich bei Kontakt mit einer Lösung verfärben. Andererseits gibt es auch Flüssigkeiten die ihre Farbe wechseln bei Kontakt mit einer sauren oder alkalischen Lösung.

Bild: Wikipedoa.org

Bild: winlab.de
Was ist ein Indikator?
Fasse in eigenen Worten zusammen.
https://www.tutory.de/entdecken/dokument/0f9ff42d
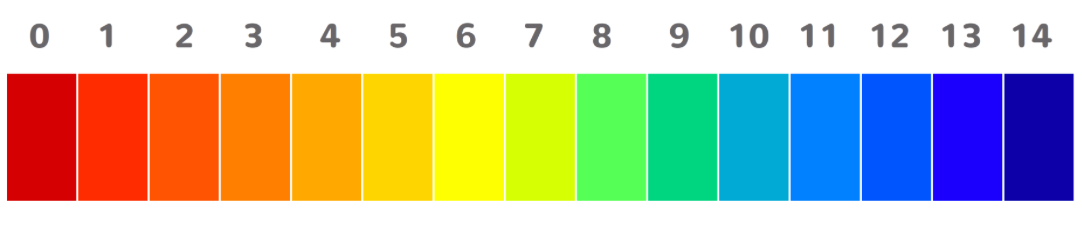
pH-Wert
Wie bereits getestet, zeigt ein Indikator an, was für ein Stoff wir vor uns haben und wie stark dieser ist. Was misst aber jetzt dieser Indikator? Woran erkennt er, was eine starke oder schwache Säure oder Base ist?
Der Indikator misst den sogenannten pH-Wert. Die pH-Skala geht von 0 bis 14, wobei verdünnte Salzsäure den pH-Wert 0 hat. Dies ist eine sehr starke Säure. Mineralwasser hat den pH-Wert 5 und reines Wasser etwa 7, also neutral. Säuren haben kleinere Werte als 7 und sind umso stärker, je niedriger der pH-Wert ist. Laugen (Basen) haben pH-Werte zwischen 7 und 14. Je höher der pH-Wert umso stärker ist die Lauge. Natronlauge hat etwa den Wert 14.
- Schreibe die untenstehenden Stoffe auf der pH-Skala (nächste Seite) an das Ort wo sie stehen würden
- Ordne folgende Begriffe auf der Skala dem richtigen Ort zu:
alkalisch, Säure, Lauge, sauer
Stoffe | pH-Wert |
|---|---|
reines Wasser | 7 |
Natronlauge | 14 |
Meerwasser | 8 |
Milch | 6,5 |
Salzsäure | 0 |
Seifenlösung | 9 |
Cola | ca. 3,5 |
Kalkwasser | 10,5 |
Zironensaft | 2.5 |
Magensäure | 1 |
Dünndarm | ca. 6-8 |
Haut | ca. 4-5,5 |
https://www.tutory.de/entdecken/dokument/0f9ff42d
https://www.tutory.de/entdecken/dokument/0f9ff42d
Zur Bedeutung des pH-Werts:
pH heisst vom lateinischen pondus Hydrogenii, was auf deutsch übersetzt "Gewicht des Wasserstoffs" bedeutet.
Der pH-Wert ist also ein Mass, wie viel Wasserstoff es in einer Lösung hat. Genauer gesagt, gibt er an, wie viele Wasserstoff-Ionen sich in einer Lösung befinden.
Was ist Wasserstoff?
Im neutralen Zustand haben Atome oder Moleküle genau gleich viele Protonen im Kern wie Elektronen in der Hülle. Besitzt jetzt ein Atom oder Molekül ein oder mehrere Elektronen mehr oder weniger als im Neutralzustand, hat es dadurch eine elektrische Ladung. Die Anzahl der Protonen ist nicht mehr gleich wie die der Elektronen. Wenn dies der Fall ist, spricht man von einem Ion.
In unserem Beispiel misst ein Indikator die Anzahl Wasserstoff-Ionen in einer Lösung und gibt somit den pH-Wert an. Diese Wasserstoff-Ionen werden normalerweise Protonen genannt, da sie nur noch aus einem Wasserstoff-Proton bestehen.
Normales Wasserstoff Atom:
Wasserstoff-Ion (Proton):
Skizze
Skizze
https://www.tutory.de/entdecken/dokument/0f9ff42d
Die Wirkung von Säuren und Basen (Laugen)
Reinigungshelfer
Wenn man das Badezimmer putzt, kommt oftmals Essigreiniger oder andere Mittel gegen den Kalk zum Einsatz. Jedoch greifen diese Mittel auch unsere Haut an, darum schützt man sich mit Gummihandschuhen. Stärkere Säuren, wie die Salzsäure, reagieren sogar mit Metallen. Die Säuren haben eine ätzende Wirkung.
In die Abflüsse giesst man Abflussreiniger um die Haare und sonstige Verklebungen zu lösen. Ein Blick auf die Flasche zeigt, dass es in diesem Reiniger Natriumhydroxid hat. Wird dies mit Wasser in das verstopfte Rohr gegeben, bildet sich die aggressive Natronlauge. Meist lässt man diese Mittel noch etwas "einwirken", damit die Lauge ihre Arbeit verrichten kann. Aber Natronlauge wird auch in der Bäckerei verwendet. Dort wird sie, stark verdünnt, vor dem Backen auf die Brötchen gestrichen und verleiht den Laugengebäcken während des Backens das typisch braune Aussehen.
Die Lauge wirkt auch ätzend, somit ist die Wirkung der Säuren und Basen gleich. Ein Unterschied zur Säure ist, dass die Base nicht mehr sauer sondern alkalisch reagiert. Wegen der chemischen Reaktion die geschieht, unterscheidet man Säuren und Basen.
Es gibt aber auch Materialien, welche die Säuren oder Basen nicht angreifen - zum Beispiel Glas. Deshalb werden viele dieser Stoffe in Glasflaschen aufbewahrt.
https://www.tutory.de/entdecken/dokument/0f9ff42d
Wer unsachgemäss mit Säuren umgeht, riskiert gefährliche Verletzungen (Verätzungen). Die Augen sind durch Spritzer besonders gefährdet. Darum müssen sie im Umgang mit Säuren oder auch Basen geschützt werden. Je nach Experiment empfiehlt sich auch ein Arbeitsmantel und Schutzhandschuhe. Man sollte niemals die Nase direkt über die Öffnung einer Flasche mit Säure darin halten um den Geruch zu riechen. Dabei verbindet sich das aufsteigende Gas mit dem Wasser auf unserer Nasenschleimhaut zu Säure und führt zu Verletzungen und Atemnot.
Konzentrierte Säuren verdünnen
Wie stark eine Säure ist, hängt nicht nur von ihrer Art, sondern auch von ihrer Konzentration ab. In der Schule wird oft mit verdünnten Säuren und Basen gearbeitet. Will man im Labor aus konzentrierter Säure eine verdünnte Lösung herstellen, ist besondere Vorsicht notwendig. Die Säure wird tropfenweise zum Wasser gegeben, NIE umgekehrt. Sonst erwärmt sich die Mischung und die Flüssigkeit kann spritzen.

Zuerst das Wasser, dann die Säure, sonst geschieht das Ungeheure
Bild: Dossier Säuren und Basen (winlab.de)
https://www.tutory.de/entdecken/dokument/0f9ff42d
Experiment 3 - Reinigungsmittel testen
Versuch 1: Badreiniger
Materialien: Chemiebox, Kalksteinchen, Kalkpulver Badreiniger, Speiseessig, destilliertes Wasser, 4 Reagenzgläser, Reagenzglasständer, Becherglas
Versuchsdurchführung
- Stellt alle Materialien die gebraucht werden bereit.
- Gebt in 3 Reagenzgläser je einen kleinen Kalkstein. In das letzte Reagenzglas eine Messerspitze Kalkpulver.
- Löst im Becherglas etwas vom Badreiniger in destilliertem Wasser.
- Füllt einen der Reagenzgläser mit der Reiniger-Lösung, eine mit Speiseessig und eine mit destilliertem Wasser. In das Reagenzglas mit dem Kalkpulver gebt ihr auch eine kleine Menge Essig.
- Beobachtet was passiert und schreibt eure Erkentnisse auf.
Was passiert mit den Kalksteinen?
Könnt ihr etwas spezielles an der Oberfläche erkennen?
Was passiert mit dem Kalkpulver?
Könnt ihr nach einiger Zeit einen Unterschied zwischen den Reagenzgläsern mit Essig, Rohrreiniger und destilliertem Wasser erkennen? Beschreibt genau.
https://www.tutory.de/entdecken/dokument/0f9ff42d
Materialien: Chemiebox, Abflussreiniger, Reagenzgläser, Reagenzglasständer, Becherglas, Haare, Wollfasern, Butter, destilliertes Wasser
Versuchsdurchführung:
- Stellt alle Materialien die gebraucht werden bereit.
- Löst im Becherglas etwas vom Rohrreiniger in destilliertem Wasser.
- Gebt in die Reagenzgläser jeweils eine Probe der verschiedenen organischen Materialien.
- Beobachtet heute und das nächste Mal, was passiert und was sich verändert.
Beobachtungen heute:
Haare:
Wollfasern:
Butter:
Beobachtungen in einer Woche:
Haare:
Wollfasern:
Butter:
https://www.tutory.de/entdecken/dokument/0f9ff42d
Einzelarbeit
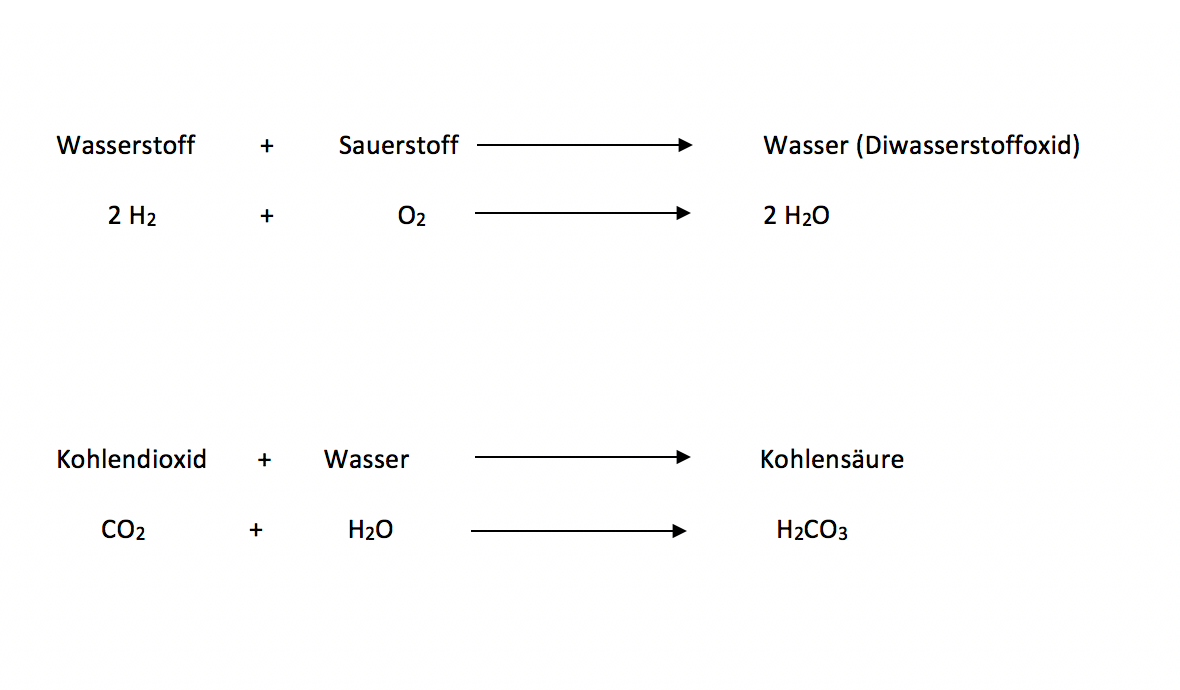
Chemische Reaktion (Reaktionsgleichung)
Setze folgende Begriffe in die Lücken: Edukte, chemischen Reaktionen, Reaktionsgleichung, Produkte
Bei werden Ausgangsstoffe, die , unter Abgabe oder Aufnahme von Reaktionswärme in neue Stoffe, die , umgewandelt. Aus „Stoff a“ und „Stoff b“ wird zum Beispiel ein neuer „Stoff c“ Dies stellt der Chemiker in einer dar.
Beschriftet folgende Gleichungen mit den Begriffen Reaktionspfeil, Edukt 1, Produkt und Edukt 2
Eine Säure oder eine Base ist normalerweise immer verdünnt. Man nennt dies dann, eine saure oder basische Lösung.
Verdünnt ist die Säure oder Base meist mit Wasser, darum ist sie nicht eine 100%-ige Säure. Je stärker eine Säure oder Base verdünnt ist, desto schwächer wird ihre Wirkung.
In Wasser werden die Säuren und Basen in Ionen zerlegt. Diese Ionen werden hydratisiert
(vom Wasser ummantelt).
Für die Säure heisst dies: Das Wasserstoff in der Säure gibt ein Elektron ab und ist als negatives Wasserstoff-Ion im Wasser vorhanden. Der Rest bildet ein negativer Säurerest-Ion.
Beispiel: Salzsäure mit der Formel HCl

Eine Säure, die in Wasser gelöst ist, besteht immer aus -Ionen
https://www.tutory.de/entdecken/dokument/0f9ff42d
Für die Base heisst dies: Die OH-Gruppe gibt ein Elektron ab und ist als negative OH-Gruppe vorhanden. Der Rest der Base bildet ein positives Baserest-Ion.
Beispiel: Natronlauge mit der Formel NaOH

Eine Base, die in Wasser gelöst ist, besteht immer aus -Ionen
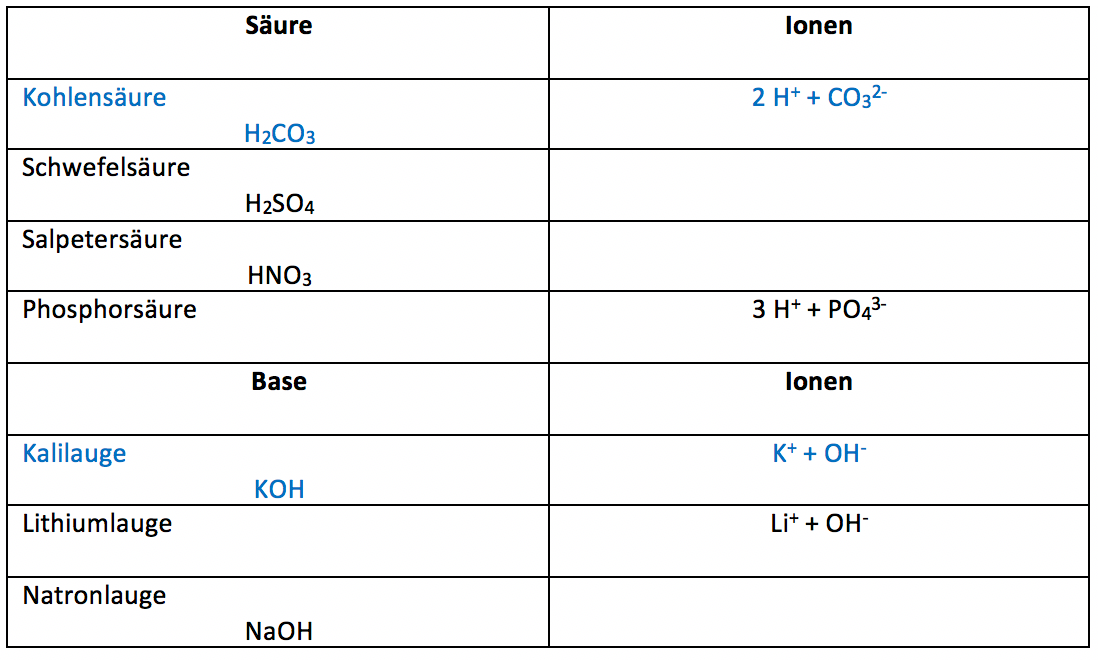
Partnerarbeit
Ergänzt folgende Tabelle mit den Säuren oder den Ionen
https://www.tutory.de/entdecken/dokument/0f9ff42d
Neutralisation
Was passiert nun, wenn man eine sehr starke Säure mit einer sehr starken Base mischt?
Logischerweise müsste die ätzende Wirkung noch steigen, da man die beiden Stoffe mischt.
Wenn man jedoch Säuren und Basen zusammengiesst dann nähert sich der pH-Wert immer mehr der 7. Das heisst also, dass die Lösung neutraler wird. Dies kann man ganz leicht testen, wenn man zu einer Säure eine Base hinzugibt und die Farbveränderung vom Indikator beobachtet.
Experiment 4 - Neutralisation
Material: Chemieboxen (Reagenzglas und Reagenzglasständer), Natronlauge, Salzsäure, Indikator, Pipette, Schutzbrillen, Handschuhe
ACHTUNG: Schutzmassnahmen einhalten
Versuchsdurchführung
- Holt am Tisch vorne folgende Materialien:
- Reagenzglas, worin sich ein wenig Salzsäure mit Indikator befindet.
- Becherglas mit Natronlauge darin.
- Pipette - Findet jetzt heraus, welchen pH-Wert die Säure ungefähr hat (Skala).
- Nun tropft ihr langsam und vorsichtig die Natronlauge hinzu, bis ihr eine neutrale Lösung habt.
- Bearbeitet die Fragen und Aufgaben.
Beobachtung beim hinzufügen der Lauge (Farbveränderung):
Beschreibung, was passiert:
https://www.tutory.de/entdecken/dokument/0f9ff42d

Wie lautet die Reaktionsgleichung?
Dargestellt mit den Formeln:

Dargestellt mit den Ionen:
https://www.tutory.de/entdecken/dokument/0f9ff42d
Herstellung einer Lauge (Rohrreiniger)
Eine Natronlauge besteht aus den Bausteinen Natrium, Sauerstoff und Wasserstoff (NaOH). Wir können sie desshalb herstellen, indem wir Natrium in Wasser geben. Das Natrium reagiert heftig mit dem Wasser zu Natronlauge.
Material: Petrischale, Natrium, Wasser, Phenolphthalein-Lösung (Indikator), Messer, Pinzette
- Beobachte das Experiment und beschreibe später was du gesehen hast.
Beobachtung:
Reaktionsgleichung:
https://www.tutory.de/entdecken/dokument/0f9ff42d


