Wozu benötigen wir Modelle in der Chemie?
Ein Modell ist ein Abbild der Wirklichkeit. Wir benötigen Modelle, wenn die Dinge, die wir untersuchen möchten, sehr groß oder sehr klein sind.
Vorallem in der Chemie sind Modelle sehr nützlich, um eine bessere Vorstellung davon zu erhalten, woraus alle Stoffe aufgebaut sind: Atome.
Atome sind so klein, dass selbst die besten Mikroskope kein genaues Bild von Atomen zeigen können. Damit wir trotzdem viele Eigenschaften und Besonderheiten sowie das Verhalten bei Reaktionen erklären können, benötigen wir Modelle.
Modelle werden also immer für einen bestimmten Zweck entwickelt. Sie müssen so einfach wie möglich, aber genau genug sein, um einen Sachverhalt oder eine Idee veranschaulich zu können. Ein Modell ist daher weder richtig noch falsch, sondern nur für einen bestimmten Zweck geeignet oder nicht geeignet. Daher werden bestimmte Modelle weiterentwickelt, wenn das alte Modell nicht mehr für einen bestimmten Zweck geeignet ist.
Atome- die kleinsten Teilchen chemischer Elemente
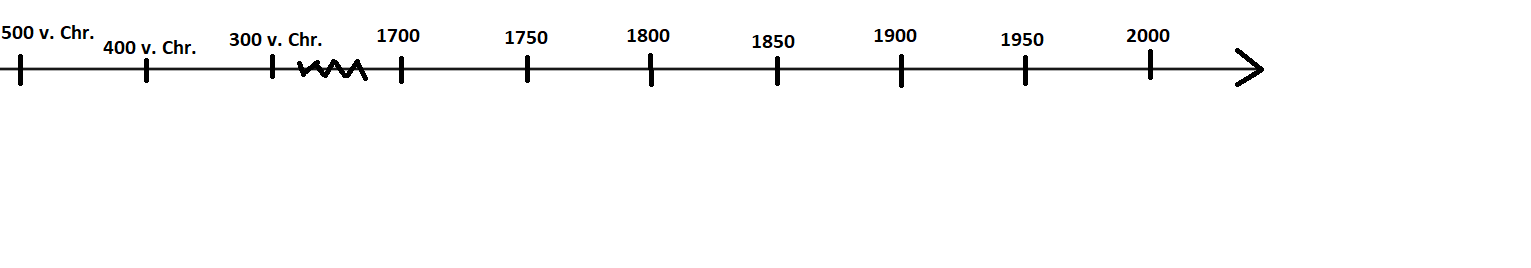
- Fülle die untere Zeitleiste aus. Trage dazu die passende Jahreszahl, den Entdecker/ Chemiker und seine Erkennnis (kurze Zusammenfassung) ein.
- Was ist ein Atom? Schreibe ein Erklärung in das untere Kästchen.
- Nenne die wichtigsten Punkte von Daltons Atomtheorie in deinem Heft.
https://www.tutory.de/entdecken/dokument/9e57afcf
Aus der Geschichte: von den Atomen
Bereits lange vor unserer Zeitrechnung haben sich Menschen über den Ursprung der Natur und ihrer Phänomene Gedanken gemacht. (Natur-) Philosophen stellten Fragen an die Natur, äußerten Vermutungen und versuchten Antworten auf die Frage zu finden, woraus die Welt besteht.
Die bedeutendsten griechischen Naturphilisophen des Altertums waren Leukipp (um 450 v. Chr.) und Demokrit ( ca. 460-370 v. Chr.). Nach ihrer Vorstellung setzten sich alle Dinge aus Teilchen zusammen, die mit dem Auge nicht sichtbar sind. Diese Teilchen sind winzig klein und können nicht weiter zerkleinert werden. Daher benannten sie diese Teilchen als Atome (vom griechischen Wort "atomos" für unteilbar). Atome unterscheiden sich in ihrer Form und Größe. Die Atome befinden sich ständig in Bewegung und treiben im leeren Raum umher. Durch zeitweillige Verbindungen untereinander bauen sie alle Stoffe auf.
Diese Überlegungen zu den kleinsten Teilchen wurde damals stark angezweifelt, da man die Teilchen ja nicht sehen konnte und alle Theorien nicht beweisbar waren. So geriet die Theorie allmählich in Vergessenheit. Im Laufe der Jahrhunterte machten dann aber einige Wissenschaftler Beobachtungen, die für den Aufbau der Stoff aus Atomen sprachen.
Der englische Chemiker John Dalton (1766-1844) griff Demokrits Vorstellungen wieder auf und zog sie zur Deutung von Experimenten heran. Er entwickelte die Atomvorstellung so bemerkenswert weiter, dass er heute als Begründer der modernen Atomtheorie gilt.
Die wichtigsten Aussagen von Daltons Atomtheorie sind folgende:
Er kam zu der Erkenntnis, dass chemisch Elemente jeweils aus einer Sorte von Atomen bestehen. Die Atome sind massive Kugelteilchen. Es gibt genau so viele Sorten wie es Elemente gibt. Alle Atome eines Elements sind gleich groß und gleich schwer. Die Atome unterschiedlicher Elemente unterscheiden sich voneinander durch Größe und Gewicht. Auch Dalton war der Meinung, dass es nicht möglich ist, Atome in noch kleinere Teile zu zerlegen oder zu zerstören. Bei chemischen Reaktionen werden Atome umgruppiert. In chemischen Verbindungen treten die Atome in ganz bestimmten einfachen Zahlenverhältnisen auf.
Durch Dalton wurde die Atomtheorie in die moderne Chemie geführt (1808).
Um die elektrischen Eigenschaften der Stoffe und die chemischen Bindungskräfte erklären zu können, reicht das Kugelteilchenmodell jedoch nicht aus. Daher suchte man nach Möglichkeiten, mehr über das Innere von Atomen herauszufinden. Dies gelang Joseph John Thompson 1904 mithilfe seines Rosinenkuchenmodells.


https://www.tutory.de/entdecken/dokument/9e57afcf


